トピックス
非貴金属触媒を使って常温でアンモニアを窒素と水素に変換-アンモニアのエネルギー利用によってカーボンニュートラルに貢献-
- (2021年6月 8日 掲載)
-
大学院創成科学研究科名木田賢治さん(令和3年3月博士前期課程修了)、湯原良基さん(博士前期課程1年)、中山雅晴教授(応用化学分野)の研究グループは、片山 祐助教(応用化学分野)、藤井健太教授(応用化学分野)らの研究グループと共同で、アンモニアの電気化学的触媒酸化において、有害な窒素酸化物(NO3-、NO2-など)を発生せず、無害な窒素のみを生成する非貴金属触媒の開発に成功しました。
本研究成果は、2021年5月27日にアメリカ化学会誌「Applied Materials & Interfaces」のオンライン版で公開され、表紙絵(Supplementary cover)にも選定されました。研究の詳細はこちら(PDF)
概要
アンモニアは肥料を始めとする化学原料として世界中で使われてきましたが、最近、エネルギー分野での利用が注目されています(経済産業省資源エネルギー庁ホームページより)。その理由の一つは、アンモニアがカーボンニュートラルを実現するための切り札である水素の「キャリア(輸送媒体)」となる可能性があるからです。アンモニア(NH3)は分子中に17.8wt%もの水素を蓄えています。水素は燃焼時にCO2を発生しないクリーンな燃料ですが、常温・常圧で気体であり、液化するためには極低温(-253℃)が必要です。このため、水素を安全かつ大量に貯蔵・輸送することは困難です。一方、アンモニアは液化が容易なことから、すでに液化アンモニアとして広く利用されており、貯蔵・輸送技術や安全対策は確立されています。そこで、水素をアンモニアの形でいったん貯蔵・輸送し、利用する場所で水素に変換する方法が注目されています。もちろん、水素に変換する工程でCO2や有害物質を出してしまっては意味がありません。
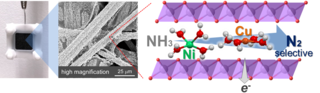
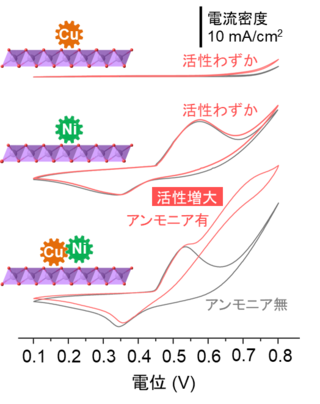
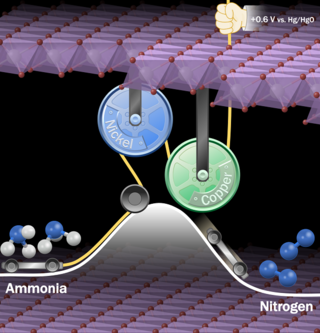
再生可能エネルギー由来の電力を使って、アンモニアを水素と窒素に分解できれば、ゼロエミッション[1]が達成されることになります。アンモニアの電気分解では陰極で水素が発生し[2]、陽極でアンモニアが酸化されます[3]。白金系触媒は電気化学的アンモニア酸化に対して高い活性をもつことが知られていますが、高価である上、有害な含酸素窒素種(NO3-、NO2-など)が多く生成するという問題がありました。本研究グループは、積層二酸化マンガンの1ナノメートル程度の層間にニッケルイオンと銅イオンを同居させ、アンモニア含有水を電気分解したところ、100%に近いファラデー効率[4]で無害な窒素に変換されることを発見しました。
開発した触媒の構
アンモニア存在下、非存在での各触媒の電流応答
※表紙デザイン(Supplementary cover)、片山助教作成
用語の説明
[1] ゼロエミッション 廃棄物を一切出さない資源循環型のシステム
[2] 水素発生反応 2H2O + 2e- → H2 + 2OH-
[3] アンモニア酸化反応 2NH3 + 6OH- → N2 + 6H2O + 6e-
[4] ファラデー効率 電気分解に要した全電気量と物質の生成に寄与した電気量との割合謝辞
本研究は日本学術振興会、科学研究費補助金基盤研究(B)の助成を受けて実施しました。
論文情報
論文題目
Ni- and Cu-co-intercalated Layered Manganese Oxide for Highly Efficient Electro-oxidation of Ammonia Selective to Nitrogen
著 者
Kenji Nagita, Yoshiki Yuhara, Kenta Fujii, Yu Katayama, Masaharu Nakayama*
掲 載 誌
ACS Applied Materials & Interfaces
D O I
10.1021/acsami.1c04422